[2000年5月]
日本人は古来糖質中心の食生活を送ってきました。明治維新を経て第2次世界大戦後、日本人の食生活は、脂肪が増え砂糖を含めた糖質が極端に減少してきました。お酒を飲む際には、糖質を意識的に減らしている人が多く、そのためアルコール性肝障害が起きる。また、糖質の摂取量が糖代謝に重要な意味を持ち、糖質の摂取量が少ないと耐糖能が低下し糖尿病と判断されるという内容で今までの風説を覆す大変興味深いものです。
伝統的な糖質中心の食生活を捨てて米国人の食生活を取り入れたピマ・インディアンの35歳以上の50%が糖尿病となっていることを考えると、日本人はやはり長年の間に培われた糖質中心の食生活を送った方が良いのかもしれません。
はじめに
日本人の食生活は、古来「一日ニ玄米四合ト味噌ト少シノ野菜ヲ食べ」(宮澤賢治)であった。換言すれば、日本人の食生活の基本は「穀類+(大豆)+(野菜)+(魚介類)」であり、日本人は、過去2,000年にわたって、コメをはじめとするでん粉が主成分の穀物に支えられてきた。この食生活は明治維新によって西洋文化が導入されても基本的に変わることはなかった。しかし、太平洋戦争後、日本人の食生活は一変した。
戦後の日本で進行した食生活の変化(食生活の欧米化と称されている)は日本人の疾病構造に大きな影響(脳血管疾患の減少と結腸がん・糖尿病の増加)を与えた。
食生活の欧米化は、動物性食品(肉類・牛乳・乳製品など)の摂取量の増加と穀類(特にコメ)の消費量の減少によって特徴付けられる。白いコメのメシ(銀シャリ)は2,000年来の日本人の強い憧れであった。しかし、この憧れが現実になった時から、日本人はコメをあまり食べなくなった。
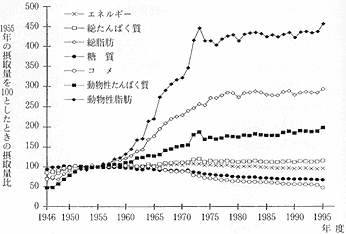
戦後の日本人の栄養摂取状況を概観する。図1は、日本人が不足ながらも一応食べ物を口にすることができるようになった1955年(昭和30年)を100として、総エネルギー、たんぱく質、脂肪、炭水化物(糖質)の1人当たりの1日摂取量の推移をコメの消費量の推移とともに示したものである。過去40年の間に総エネルギー摂取量はほとんど変化していない(1955年は2,104kcalで1995年は2,042kcal)。食糧不足の時代には、食べられるものは何でも口に入れ、飢えをしのいだ。総たんぱく質の摂取量にもあまり大きな変化はみられない(1955年は69.7gで1995年は81.5g)。しかし、脂肪の摂取量は1964年(昭和39年)頃から急激に増え始め、1990年代には1955年の3倍近くに増えた(21.8gから58〜59g)。 中でも動物性脂肪の増加が著しく、1955年の6.5gから1995年の29.8gと4.6倍に増えた。なお、たんぱく質の総摂取量には大きな変化はないものの、動物性たんぱく質は1955年の22.3gから1995年の44.4gへと2倍に増えている。
図1 日本人の栄養摂取量の年次推移
 |
|
1955年(昭和30年)の摂取量を100として1人当たりの1日平均摂取量を表す。(厚生の指標臨時増刊「国民栄養の年次推移」1995、学会センター関西/学会出版センター「糖と健康」1998年7月号による) |
一方、糖質の摂取量は1955年には411gで総摂取エネルギーの78.1%を占めていたが、1995年には280g(総摂取エネルギーの54.8%)へと減少している。コメの消費量も1959年(昭和34年)の364.4gを最高にしてそれ以降は減り続け、1995年にはとうとう167.9gに減ってしまった。この40年間に日本人が食するコメの量は半分以下になってしまったのである。最近の日本人がコメから得るエネルギーは総エネルギーの30%にすぎない。
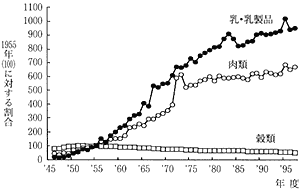
以上のことは1955年と1995年の食品摂取量の変化を表した表1においてより鮮明である。特筆すべきは、コメの減少(約2分の1)と肉類(約7倍)及び乳・乳製品(約10倍)の増大である。日本人は本来、肉食あるいは牛乳を飲用する民族ではない。肉と牛乳を栄養豊かな食品として認識するようになったのは、明治維新(欧米の生活様式を見倣うことが文明開花と言われた)後のことである。しかし、日本人が本格的に肉と牛乳を摂取するようになったのは、1965年 (昭和40年)以降のことにすぎない(図2)。
表1 戦後の食生活の変化
|
(g、1人1日当たり) |
| |
1995年(A) |
1995年(B) |
B/A |
穀類
コメ
油脂類
動物性食品
魚介類
肉 類
卵 類
乳・乳製品
砂糖類 |
480
347
4
115
77
12
12
14
16 |
262
168
17
366
97
82
42
144
10 |
0.55
0.48
4.25
3.18
1.26
6.83
3.50
10.29
0.63 |
|
(厚生の指標臨時増刊「国民栄養の年次推移」1995による) |
,/tr>
図2 乳・乳製品、肉類、穀類の摂取量の年次推移
 |
|
1955年(昭和30年)の摂取量を100として1人当たりの1日平均摂取量を表す。(厚生の指標臨時増刊「国民栄養の年次推移」1995による) |
糖質の重要性
ヒトの脳は体重のわずか2%にすぎないが、そのエネルギー消費量は20%(約500kcal)にものぼる。しかも、専らブドウ糖を利用する。脳は1日24時間働いている。したがって、脳が機能するためだけでも、少なくとも1日125g程度の糖質が必要である。糖質を摂取しないと、肝臓のグリコーゲンは16時間ほどで底をついてしまう。結局、アミノ酸や脂肪の分解によって生ずるグリセロールからの糖新生によってブドウ糖を脳に供給しなければならなくなる。
糖質は決して単なるエネルギー源ではなく、外来の化学物質(アルコールを含めて)の代謝と毒性に関して、たんぱく質や脂肪とは比較にならないほど重要な役割を演じている1)。近年の豊かな社会は、ともすれば糖質を単なるエネルギー源とみなす傾向がある。細身の体系を美しいと感じる若い女性や肥満を警戒する中年の男女は、砂糖や糖質の多い米飯(メシ)を「健康の敵」として、その摂取を避ける風潮すら認められる。
以下に、著者らの研究結果をもとにして、糖質が化学物質(アルコールを含む)の代謝と毒性に与える影響について述べ、最後に糖質と糖尿病との関係について触れる。
糖質の化学物質の代謝・毒性
細胞膜は主として脂質からなる。化学物質の吸収はこの脂質膜を介して行われるので、吸収される物質は脂溶性である。体内に入った(=吸収された)物質はいずれ排泄されなければならない。しかし、この排泄も脂質膜を通して行われるので、脂溶性のままでは排泄されない。一旦、尿中に出ても再び吸収されてしまうからである。そのために、体内に入った脂溶性の化学物質は、水溶性の物質(代謝物)に変換される。この反応に関与するのが、薬物代謝酵素と言われる酵素系である(なお、薬物は必ずしも「くすり」を意味するのではなく、分子量1,000以下の有機化合物を薬物と言っている)。この酵素系は、主として肝臓に存在するので肝薬物代謝酵素(CYPなど)と言う。この酵素系にはたくさんの種類があるが、特に分子量の小さい薬物を好んで代謝する酵素がCYP2E1である。一般的には代謝=解毒であるが、物質によっては代謝によってその毒性を発揮するものもある(代謝活性化と言う)。その代表的なものに、ジメチルニトロソアミンやジエチルニトロソアミンなどの発がん物質、クロロホルムや四塩化炭素など工場や実験室で使われる有機溶剤、アセトアミノフェンなどの医薬品がある。
特に、四塩化炭素の肝毒性が有名で、肝障害のモデル物質として動物実験に繁用されている。四塩化炭素による肝障害は、四塩化炭素そのものによって引き起こされるのではなく、四塩化炭素を体から排泄する過程において、体内(肝臓)で生成した反応性に富む中間代謝物(ラジカル)によって起こる。
一晩絶食にしたラットが四塩化炭素の蒸気を吸入すると、その代謝活性化によって、極めて強い肝障害が起こる2)。前の晩に普通に餌を食べたラットが 400ppmの四塩化炭素を4時間吸入した時、吸入開始から24時間後(この時点で毒性がピークに達する)の血清GPT(肝障害の指標)は数百で、肝臓も軽度の脂肪変性を示すのみで肝細胞の壊死はみられない。ところが、一晩絶食にしたラットでは、血清GPTは数千となり、肝中心葉に広範な細胞壊死が認められる。一晩の絶食による代謝亢進はいろいろな化学物質(有機溶剤) について確かめられている。
絶食ではすべての栄養素(たんぱく質、脂肪、糖質、ビタミン、ミネラル)の摂取量がゼロである。どの栄養素の欠落がCYP2E1の誘導に関与しているのであろうか。
筆者らは、液体飼料(成分を変えるのに便利である)中のたんぱく質・脂肪・糖質を単独あるいは交互に変えた飼料でラットを飼育し、肝臓のCYPの活性を測定した1)。その結果、肝ミクロソームのCYPの活性が、たんぱく質や脂肪ではなく、糖質の摂取量によって一元的に支配されていることを発見した。すなわち、たんぱく質や脂肪の摂取量とは関係なく、糖質の摂取量が増えれば活性が低下し、逆に摂取量が減れば活性が亢進したのである。糖質の含有量をたんぱく質あるいは脂肪と置き換えて、総摂取エネルギーを一定に保つた場合でも、たんぱく質と脂肪の含有量を一定に保ちながら糖質の含有量だけを変えた場合(したがって、総摂取エネルギーは糖質含有量に伴って変動する)でも、糖質摂取量の減少(増加)によってCYPの活性が亢進(低下)した。糖質摂取量が等しい場合には、たんぱく質や脂肪の摂取量が大きく変化してもCYPの活性には有意の変化は認められなかった。特に、糖質を全く含まない餌(たんぱく質、脂肪、ビタミン、ミネラルなどは十分含まれている)で飼育すると、完全絶食の場合と同程度の極めて高度の肝障害が起こった。
糖質とアルコールの化学物質の代謝と毒性に対する相互作用
昔から、愛飲家では「くすり」の作用が異なるとか、小量の四塩化炭素によって普通では考えられないほどに激烈な肝障害の起こることが知られていた。実験的にもアルコールの急性あるいは慢性投与によって四塩化炭素をはじめとする肝障害性薬物の毒性増強が報告されている。筆者らもアルコールの1回あるいは繰り返し投与によって四塩化炭素など多数の揮発性炭化水素の代謝が亢進することをラットを用いた動物実験で確認している3、4)。この代謝亢進は、絶食あるいは低炭水化物食による場合と同様に、CYP2E1の誘導によってもたらされる。
「お酒を飲むときにはご飯(澱粉)を減らしなさい」などという誤った風説が行きわたっているためか、飲酒者では糖質摂取量が少ない。この風説は、アルコール(7kcal/g)が糖質(4kcal/g)と同様のエネルギー源であると考えられているためらしい。そこで、長野市周辺に居住する健康な成人男性2,165人について飲酒と栄養摂取状況を調べてみた5)。
飲酒の食品摂取に対する影響をみると、飲酒量の増加に伴って穀類、芋類、菓子類、砂糖類などが減少し、肉類の摂取量が増えていた。特に、飲酒量が増えるに従って穀類の減少が著しい。栄養素の摂取エネルギー比でみると一番減少したのは糖質である。すなわち、飲酒者では、飲酒量の増加に伴って糖質源の食品(特に穀類)の摂取が減少する。「お酒を飲む時にはご飯(澱粉)を減らしなさい」は、単なる風説ではなく、飲酒者はこれを忠実に守っている。したがって、「アルコール+低糖質食」は、人間社会において決して例外的なものではなく、むしろ一般的な慣習である。
アルコールは、CYP2E1を誘導する。先に述べたように、低糖質食もCYP2E1を誘導する。では「アルコール+低糖質食」ではどうなるか。「アルコール+低糖質食」による代謝亢進は、「アルコールによる亢進」と「低糖質食による亢進」の単なる足し算に比べてずっと大きい。つまり、アルコールによるCYP2E1の誘導は、低糖質食によって相乗的に増大する。アルコールによる代謝亢進は、アルコールとともに摂取される糖質の量に依存し、糖質が少なければ少ないほどその代謝亢進が増幅される6)。
糖質とアルコール性肝障害
アルコール性肝障害の成因に関して、アルコールの直接障害説と飲酒に伴う栄養不良(たんぱく質とビタミンの不足)を重視する間接障害説が長年対立してきたが、RubinとLieber7)が「栄養学的に十分な組成をもつ液体食」(Lieber食)を用いてヒヒ(baboon)に肝硬変をつくることに成功してから(1974年)、直接障害説が有力となった。現在、アルコール性肝障害に関する研究は、ほとんどこのLieber食を用いて行われている。
Lieberらはこの液体食が大量飲酒者に不足しがちなたんぱく質とビタミンを十分含むという点で「栄養学的に十分な組成をもつ液体飼料」であると主張した。しかし、Lieber食は極端な低糖質食(糖質=総摂取エネルギーの11%)に大量のアルコールを加えたものである。Lieber食は糖質が不足しているという点で、栄養学的に十分な組成をもつとは言い難い。事実、Lieber食で飼育したラットは生長が抑制される。
日本酒、焼酎、ビール、ウイスキーなどのアルコール飲料は糖質の発酵によってつくられる。しかし、哺乳動物の細胞には「糖質→アルコール」を触媒する酵素は存在しない。哺乳動物の体内では、アルコールは酢酸(CH3 COOH)に変換される。化学構造からみて、酢酸は脂肪鎖の最も短い脂肪酸(短鎖脂肪酸)である。つまり、アルコールは脂肪に似ている。アルコールは糖質の代替エネルギーではない。アルコールを飲用する時には、糖質を減らすのではなく、脂肪を減らさなくてはならないのである。
アルコールはアルコール脱水素酵素(ADH)のみならずCYP2E1によっても代謝される。特に、大量のアルコールを飲用した時にはCYP2E1の関与が大きい。アルコールは、いずれの代謝経路でも、アセトアルデヒドを経て酢酸に代謝される。CYP2E1によるアルコールの代謝は分子状の酸素の活性化によって行われるので、代謝の過程で活性酸素が発生する。この活性酸素がCYP2E1の局在するミクロソーム膜の脂質過酸化を起こし、アルコールによる細胞障害の原因となる。
「アルコール+低糖質食」によって、CYP2E1が相乗的に誘導されるとともに脂質過酸化を抑える還元型グルタチオン(GSH)が減少する。飲酒時に糖質摂取が減少するとCYP2E1の誘導と肝GSHの減少があいまって、活性酸素の発生と脂質過酸化を促し、アルコール性肝障害を引き起こす。
このことを検証した動物実験の結果を述べる。3群のラット(1群10尾)を「コントロール食」(たんぱく質18%;脂肪35%;糖質47%)、「アルコール+低脂肪食」及び「アルコール+低糖質食」で4週間飼育した8)。これらの食餌はいずれも液体食である。「アルコール+低脂肪食」と「アルコール+低糖質食」は、「コントロール食」の脂肪と糖質をそれぞれ等エネルギー的にアルコールで置き換えたものである。したがって、これら3種類の液体食は等エネルギーとなっている。4週間の飼育後に、ラットを屠殺して肝組織の中性脂肪含有量(脂肪肝の指標)、γ−グルタミルトランスペプチダーゼ(γ−glutamyltranspeptidase;γ−GTP)の活性(アルコール性肝機能障害の指標)を測定するとともに、肝組織の組織学的検索を行った(表2)。「アルコール+低糖質食」は、「アルコール+低脂肪食」に比べて肝臓に対してはるかに強い悪影響を与えることがお分かりいただけるだろう。脂肪の少ない(=糖質の多い)食餌とともに与えたアルコールは脂肪肝(アルコール性肝障害の初期変化)すら起こさない。
「低脂肪食+アルコール」 と 「低糖質食+アルコール」 による肝臓の変化
| 食事 |
CYP2E1a |
中性脂肪b |
γ-GTPc |
脂肪変性d |
| − |
1+ |
2+ |
| コントロール食 |
0.96 |
33.3 |
0.34 |
9 |
1 |
0 |
| 低脂肪食+アルコール |
3.29e |
21.8e |
0.44e |
7 |
2 |
1 |
| 低糖質食+アルコール |
6.81ef |
53.8ef |
0.82ef |
2 |
3 |
5 |
|
CYP2E1、中性脂肪、γ-GTPは10尾のラットの平均値。脂肪変性はそれぞれの変化を示したラット数で表わす。
a:CYP2E1に親和性のあるジメチルニトロソアミンの代謝速度(nmol/mg ミクロソームたんぱく質/min)
b:mg/g 肝
c:IU/g 肝
d:脂肪変性は−、変化なし;1+、脂肪滴の小さな脂肪変性;2+、脂肪滴の大きな脂肪変性
e:「コントロール食」との間に有意差あり。
f:「低脂肪食+アルコール」との間に有意差あり。 |
|
(学会センター関西/学会出版センター「糖と健康」1998年7月による) |
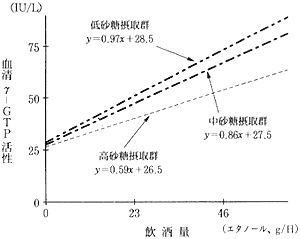
このことを人間で実証するために、疫学調査で飲酒量と血清γ−GTPの関係に影響を与える栄養因子を調べた9)。重回帰分析において、飲酒によるγ−GTPの上昇に影響を与える栄養要因は、砂糖と果物類の摂取量であった。砂糖の摂取量によって被験者を3群(多量、中等度、小量)に分け、各群について飲酒量とγ−GTPの関係を調べてみた。その結果、砂糖の摂取が少ない飲酒者で血清γ−GTPの活性の高いことが判明した(図3)。果物は、それ自身血清γ−GTP活性を下げる方向に働くが、アルコールによるγ−GTP活性の上昇に対しては、砂糖のような明確な影響は確認できなかった。
図3 砂糖摂取量が飲酒によるγ−GTPの上昇に与える影響
 |
|
砂糖の摂取量別にみたγ−GTP(y)とアルコール消費量(x)の回帰直線を示す。回帰式はy=ax+b(aとbは定数)として表した。各回帰式の括弧内の数値はaとbの95%信頼区間である。低砂糖摂取郡(砂糖摂取量<16g/日)と高砂糖摂取量(砂糖摂取量>35g/日)との間に回帰係数の有意差(p<0.05)が認められた。すなわち、砂糖の摂取量が多い飲酒者では、飲酒によるγ−GTPの上昇が軽度である。 |
(学会センター関西/学会出版センター「糖と健康」
1998年7月号による) |
そのメカニズムは明らかではないが、甘いもの(砂糖や果物)は飲酒による肝障害に対して好ましい影響を与えるらしい。従来、飲酒時の栄養に関しては、たんぱく質とビタミンの重要性が強調され、糖質は逆に摂取を控えることが望ましいとさえ言われてきた。これは誤解である。アルコールは糖質よりも脂肪に近い。飲酒時には糖質(でん粉あるいは甘いもの)を控えるよりも、脂肪分を控えた方が健康的である。
糖質は糖尿病の予防と進展防止に役立つか?
今まで「糖質は健康に良い」と言ってきた。読者の中には「そんなに糖質を摂っていたら糖尿病になってしまう」と心配する向きもあろう。糖尿病は、脳・心・腎血管障害の基礎疾患として人間の健康に重大なかかわりをもつ病態である。最近の日本における糖尿病患者は600万人とも1,000万人とも言われ、さらに増加傾向は急激である。
今までの糖尿病の発生に関する報告は、エネルギーの過剰摂取(特に脂肪摂取量の増加)と身体活動の低下(→肥満)を糖尿病の危険因子として指摘してきた。しかし、前述のように、脂肪摂取量の増加の背後には、糖質摂取量の相対的減少が存在する(図1、2)。
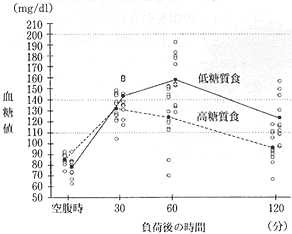
糖質の摂取量自体が糖代謝に重要な役割を演じている実験的証拠を以下に示す。ヒトボランティアにブドウ糖負荷試験の前日に糖質の少ない食事を与えると、耐糖能が著しく悪化する。特記すべきは、糖負荷試験の前日の朝食と昼食に普通の食事(たんぱく質15%;脂肪25%;糖質60%)摂り、夕食だけ糖質の少ない食事(たんぱく質30%;脂肪60%;糖質10%)を与えたところ、全例において耐糖能が悪化したことである。被験者12名中4名がWHOの診断基準で「耐糖能異常」と判定されてしまった(図4)10、11)。夕食に糖質の多い食事を摂った時には、被験者の耐糖能は正常であったから、検査の15〜16 時間前の糖質摂取量が耐糖能に大きな影響をもたらすのである。
図4 糖負荷試験前日の夕食に低糖質食を摂ったことによる耐糖能の悪化
 |
|
検査前日の夕食に低糖質食を摂ったときには、12名中4名が耐糖能異常(負荷2時間後の血糖値は157、144、150、144mg/dl)と判定された。被験者が高糖質食を摂ったときには、これら4名の負荷2時間後の血糖値はそれぞれ97、105、118、93mg/dlであった。検査前に糖質の摂取量が少ないと誤って耐糖能異常と判定されてしまうことがある。 |
(学会センター関西/学会出版センター「糖と健康」
1998年7月号による) |
このことは、筆者らの新規の発見ではない。検査前の低糖質食が耐糖能を悪化することは、古くから知られていた。今から60年も前にロンドン大学病院のH.P. Himsworth112)が正常(糖尿病ではない)な健康人に糖質の少ない食事を1週間与えて糖負荷試験を行っている。高糖質食を与えた時には、耐糖能は正常であったのに、低糖質食によって糖尿病と判定されるほどに耐糖能が悪化した。しかも、糖質と脂肪の比率を一定に保ちながら総エネルギーを増減させたり、総エネルギーを一定にして糖質と脂肪の比率を変えたりして、耐糖能が検査前の糖質摂取量によってのみ変動することを確認した。この報告を契機にして、糖負荷試験の前、少なくとも3日間は、1日300g以上の糖質摂取が必要であると言われていた。
しかし、1960年にH. L. C. Wilkerson13)が低糖質食が人体の耐糖能に与える影響を再検討して、糖質の摂取量を1日50gに制限しても耐糖能には大きな影響を及ぼさないという報告を行った。この報告がNew England Journal of Medicineという影響力の大きな医学誌に掲載されたために、アメリカ糖尿病協会は1日300gという糖質はアメリカ人には多すぎるとし、1日150gの糖質で十分であるという判断を下した。WHOもこれにならい、糖負荷試験の前には1日150g以上の糖質を摂ることを被験者に指示することを勧告している。
しかし、Wilkersonの報告を子細に検討すると、観察結果に矛盾がある。1日50gの糖質制限食を3日間与えられた42名の男性で負荷後1時間の血糖値は116±30mg/dlで170mg/dlに達したものは1人もいなかったが、この時間帯に尿糖が16.3%の被験者が認められた。空腹時(糖負荷前)の尿糖は全員陰性であったから、負荷後1時間の尿糖陽性は腎臓の糖排泄閾値(いきち)である170〜180mg/dlを超える血糖上昇があったことを示している。
筆者らの実験で夕食に低糖質食を食べた被験者のその日の糖質摂取量は3.0g/kgであった。体重が60kgの人の糖質摂取量は180g/日である。したがって、WHOの基準に合致している(被験者は通常270g/日以上の糖質を摂っていた)。
一般の人は「糖質は糖尿病に悪い」と頭から信じ込んでいるから、検査前に糖質の摂取を控えてしまうものがいる。医師は、空腹時血糖値が70〜80mg/dlで、負荷1時間後あるいは2時間後の血糖値が200mg/dlを超えるような人には、検査前日に糖質の多い食事を摂るように指示して再検査しなければならない。
1997年にアメリカ糖尿病協会は、糖負荷試験は患者の負担が大きいことに加え、同じ人に検査を行っても検査結果にバラツキが大きいという理由で、糖負荷試験よりも空腹時血糖の方が糖尿病の検査として望ましいという勧告を行っている14)。しかし、糖尿病の合併症として問題になる糖尿病性網膜症については、糖負荷試験の2時間値の方が空腹時血糖値より識別能に優れている。それにもかかわらず、空腹時血糖が良いとされた最大の理由は、個体内のバラツキである。検査前日夕食の糖質摂取量がこのバラツキを生ずる要因の1つである。医師も疫学者も是非検査前日の夕食に注意を払ってほしい。
筆者らの実験的研究で、日本人の中には低糖質食に強く反応して耐糖能が著しく低下する人が約30%いることが分かった。この低糖質食に対する高感受性者が低糖質食を摂り続けると将来糖尿病になるのかどうか確認する必要がある。
元来、糖質の摂取量の少ない欧米では、糖質の重要性に関する認識が極めて乏しい。総カロリーの80%を糖質が占める高糖質食が糖尿病患者の血糖管理に有効であるという報告15)が行われて久しいが、このような食事は欧米人の嗜好に合わないという理由で相手にされなかった。しかし、最近は、欧米でも糖質の重要性に関する認識に変化が認められるようになった。1992年になってやっと米国糖尿病協会は、糖尿病患者(NIDDM)の治療食として高糖質食(ただし糖質は55〜60%)を勧告している。しかし依然として、高糖質食の有用性に反対する意見が根強い。
米国に移住した日本人における糖尿病の発生率は米国人の2〜4倍である16)。なぜ日本人が糖尿病になりやすいのか、その遺伝的背景は明らかではない。伝統的な穀類中心の食生活を捨てて米国人の食生活を取り入れたピマ・インディアン(インスリン分泌能が低い)においては、100年前には糖尿病は皆無であったのに、現在では35歳以上の 50%が糖尿病になる。
糖質(穀類)中心の食生活では少量のインスリンでこと足りるが、たんぱく質・脂肪の摂取量が多くなるとインスリン要求量が増える。日本における最近の糖尿病の増加原因は、過去数千年にわたってエネルギー源として糖質(穀物澱粉)を利用してきたことによって形成された身体(日本人はインスリン分泌能が低い)に適応しない食生活(糖質摂取量が少ない)にあると考えられる。日本においては、この生理機能に応じた日本型食生活が望ましい。筆者らは、最近の糖尿病患者の増加は単にエネルギーあるいは脂肪の過剰摂取というよりはむしろ糖質摂取の減少そのものにその原因があると考えている。
参考文献
| 1. |
Nakajima T, Koyama Y, Sato A. Dietary modification of metabolism and toxicity of chemical substances-with special reference to carbohydrate. Biochem Pharmacol 31, 1005-1011, 1982. |
| 2. |
Sato A, Nakajima T. Enhanced activity of liver drug-metabolizing enzymes for aromatic and chlorinated hydrocarbons following food deprivation. Toxicol Appl Pharmacol 50, 549-556, 1979. |
| 3. |
Sato A, Nakaj ima N, Koyama Y. Dose-related effects of a single dose of ethanol on the metabolism in rat liver of some aromatic and chlorinated hydrocarbons. Toxicol Appl Pharmacol 60, 8-15, 1981. |
| 4. |
Sato A, Nakajima T, Koyama Y. Effects of chronic ethanol consumption on hepatic metabolism of aromatic and chlorinated hydrocarbons in rats. Br J Ind Med 37, 382-386, 1980. |
| 5. |
中島民江、 太田節子、 釘本 完、 村山忍三、 佐藤章夫. 飲酒による栄養摂取状況の変化―炭水化物・蛋白質・脂肪の摂取量を中心に―. 日公衛誌39, 90-99, 1992. |
| 6. |
Sato A, Nakajima T, Koyama Y. Interaction between ethanol and carbohydrate on the metabolism in rat liver of aromatic and chlolinated hydrocarbons. Toxicol Appl Pharmacol 68, 242-249, 1983. |
| 7. |
Rubin E, Lieber CS. Fatty liver, alcoholic hepatitis and cirrhosis produced by alcohol in primates. N Engl J Med 298, 128-135, 1974. |
| 8. |
Tsukada H, Wang PY, wang Y, Kaneko T, Nakano M, Sato A. Dietary carbohydrate intake plays an important role in preventing alcoholic liver damage in the rat. J Hepatol 29, 715-724, 1998. |
| 9. |
Nakajima T, Ohta S, Fujita H, Murayama N, SatoA. Carbohydraterelated regulation of ethanol-induced increase in serum γ-glutamyltranspeptidase activity in humans. Am J Glin Nutr 60, 87-92, 1994. |
| 10. |
Kaneko T, wang P-Y, Tawata M. Sato A. Low carbohydrate intake before oral glucose-tolerance tests. Lancet 352, 289, 1998. |
| 11. |
Wang P-Y, Kaneko T, Wang Y, Tawata M, Sato A. A Iow carbohydrate intake before an oral glucose tolerance test impairs the glucose tolerance of normal adults. Tohoku J Exp Med 189-59-70, 1999. |
| 12. |
Himsworth HP. The dietetic factor determining the glucose tolerance and sensitivity to insulin of healthy men. Clin Sci 2, 67-94, 1935. |
| 13. |
Wilkerson HLC, Hyman C, Kaufman M, McCuistion AC, Francis JO. Diagnostic evaluation of oral glucose tolerance tests innondiabetic subjects after various levels of carbohydrate intake. N Engl J Med 262, 1047-1053, 1960. |
| 14. |
Expert Committee of the Diagnosis and Classification of Diabetes Mellitus. Report of the Expert Committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 20, 1183-1197, 1997. |
| 15. |
Brunzell JD, Lerner RL, Hazzard WR, Porte D Jr, Bierman EL.
Improved glucose tolerance with high carbohydrate feeding in mild diabetes. N Engl J Med 284, 521-524, 1971. |
| 16. |
Tsunehara CH, Leonetti DL, Fujimoto YY. Diet of second-generation Japanese-American men with and without non-insulin-dependent diabetes. Am J CIin Nutr 52, 731-738, 1990. |